导读
增殖能力是评价肿瘤细胞性能的重要组成部分,上一期介绍到包括MTS,SRB,克隆形成及细胞凋亡等多个实验,均可以从不同角度来评价细胞的增殖能力,今天就先看看,克隆形成实验。这虽然操作简单,却有很多同学在最终拍照时很难拿到好看的图片,不得一次又一次重复实验,今天我们就看看如何拍出漂亮的细胞克隆照片。
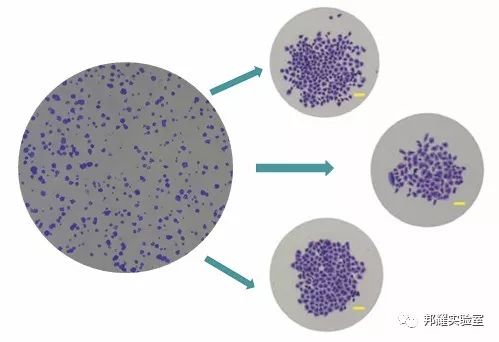
DU145细胞克隆形成的图片(相机左,显微镜右)
克隆形成的原理
“克隆”顾名思义,即体细胞无性繁殖,1个细胞分裂成2个细胞,并进行种群繁殖并扩大的过程,通过克隆形成率可以反映细胞群体依赖性和增殖能力两个重要性状,是体外测定细胞增殖能力的一种常用技术。
克隆形成的目的
1. 评价不同杀伤因素(药物、基因等)对肿瘤细胞增殖能力或群体依赖性的敏感性;
2. 评价细胞在体内成瘤性,癌细胞不一定都可以在体内成瘤,但若体外克隆能力越强,即表明体内成瘤性越强,算是一种模拟体内成瘤的体外实验。
克隆形成的分类
克隆形成依据采用的培养介质的不同,分为平板克隆和软琼脂克隆两类。
1. 平板克隆形成(Colony formation):细胞培养在培养基中,应用于贴壁的细胞。
2. 软琼脂克隆形成(soft agar colony formation):细胞被琼脂糖挂起来,主要应用于悬浮的肿瘤细胞和转化细胞系。
下面我们就具体看一下这2种实验技术的具体操作。
一、平板克隆实验过程
将细胞分离成单细胞悬液,在培养皿中接种培养,根据集落形成数量和大小来检测细胞增殖能力和致瘤性。
1. 具体过程:如下图所示

- 接种:取对数期生长的细胞以1000-4000个/孔的密度接种于6孔板;
- 于细胞培养箱中培养7-14天左右;
- 固定染色:移除培养基,PBS洗涤细胞,4%多聚甲醛固定细胞20min;移除多聚甲醛,用0.2%结晶紫染色5min;用自来水洗涤细胞,晾干,相机拍照;
- 计数:计算克隆形成率,克隆形成率=克隆数/接种细胞数*100%。
2. 数据分析:
显微镜下观察阳性克隆,即每个克隆>50个细胞,相机拍照,数克隆数(大小约在0.3-1.0 mm)计算克隆形成率,并统计克隆大小。
举例:如研究某个基因对细胞增殖的影响,敲低前列腺癌细胞株PC3的TCTN1基因,显微镜下拍照(Scale bar=250 μm)和相机拍照,克隆的大小和数量均受到抑制[1]。
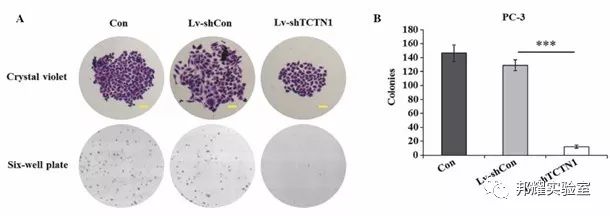
PC-3细胞的克隆形成图片[1]
常见问题解答:
- 细胞密度为多少合适?
细胞接种密度与最终实验结果密切相关,若细胞太多,形成克隆数目太多,处理结果时数克隆不仅容易出错,而且图片很难看(下图左)。细胞太少,不能形成克隆。如下图所示:
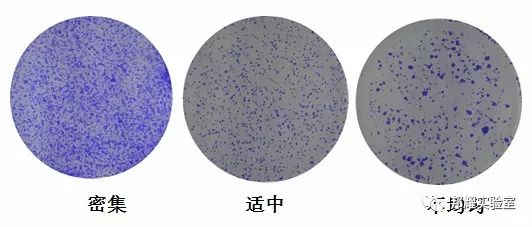
上图我们看到3株癌细胞在6孔板克隆形成图片,第一个明显铺板细胞太密集,导致难以统计数据;中间那个正好,最后面那个细胞数量偏少,且细胞铺板不均匀。因此,为了获得美观的图片和准确的数据,第一次实验最好设置细胞接种梯度,如500-1000-2000-5000个/孔挑选出最合适的接种密度。细胞在进行克隆形成实验时要求有95%以上的分散度,否则结果的准确度会受到很大影响;另外注意细胞计数时建议多计数几次。
- 细胞接种后培养的时间,如何确定?
通常情况下,单个细胞在体外增殖6代以上所组成的细胞群称为一个阳性克隆,时间约为一周;但具体时间因细胞增殖能力而已异,因此应密切关注细胞生长情况,隔天在显微镜下观察克隆情况,若单个克隆细胞数到达50个左右即可固定细胞。
- 细胞铺板均匀的重要性
若铺板不均匀,细胞稀的地方形成的克隆少,而密的地方克隆多,一方面影响统计结果,并且拍出的图片不美观,关于铺板均匀技巧可以参考往期文章。
- 细胞未形成克隆的原因?
并非每种细胞都可以形成克隆,克隆形成率与细胞本身增殖能力有关。还与接种细胞密度,加入培养液的体积、血清浓度有关。因该实验处理时间较长,应给细胞多加培养基,如每孔4ml,或者3天更换一次培养基,以供给细胞充足的营养。
- 计数时克隆数目较多,有什么快捷办法?
根据自身经验,只要细胞铺板均匀,我们可以选择分区计数,取平均数。此外,还可以用Image J软件进行计数。
二、软琼脂克隆形成
又名非锚定依赖性生长实验Anchorage-independent assay,利用软琼脂为培养介质,使细胞在悬浮状态下生长。某些恶性肿瘤细胞,不仅在贴壁状态下能增殖,在悬浮状态下也能增殖,进而通过软琼脂中形成克隆的能力反映了恶性程度,可用于细胞分化的基础研究和临床肿瘤治疗的疗效检验等方面。
1. 具体过程:如下图所示
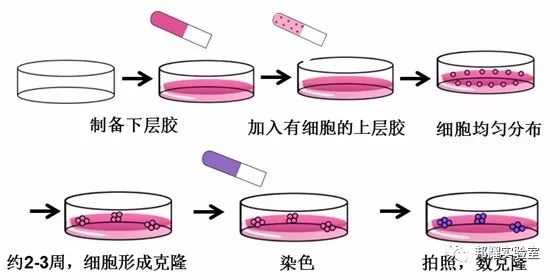
- 配制1.2% 和0.7%琼脂,高压灭菌后,维持在42℃中使其不会凝固;
- 将1.2% 琼脂与2×培养基混合,铺入6孔板作为下层胶,每孔1.5ml,37°C孵育30 min使之凝固;
- 将制备好的单细胞悬液与0.7%琼脂充分混匀,加入6孔板作为上层胶,每孔1.5ml。待其凝固后,再在上面加入培养基,每3天更换一次;
- 根据细胞的生长速度培养2~3周后显微镜下观察克隆大小,与平板克隆一样,每个克隆>50个细胞,显微镜拍照。若拍整个孔,每孔加入200μl氯化硝基四氮唑蓝(NBT)染色,37°C过夜,拍照。
2. 数据分析:显微镜或相机拍照,计算克隆形成率
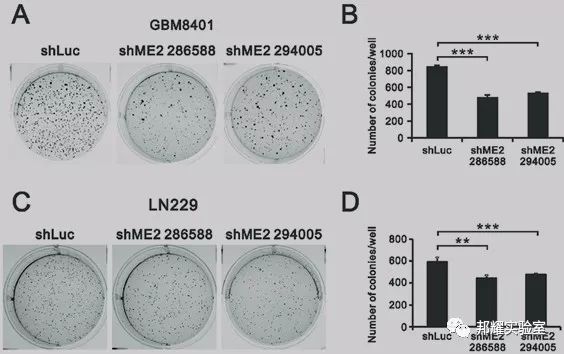
举例:通过软琼脂克隆形成实验检测ME2蛋白对神经胶质瘤细胞生长的影响。在神经胶质瘤细胞GBM8401和LN229中将ME2蛋白敲低,形成的克隆数减少[2]。
常见问题解答:
- 上下层胶的作用是什么,为什么最后要在上层胶上再铺一层培养基?
上层软琼脂使细胞分散成单个,下层软琼脂作为支撑防止细胞贴附生长。最后铺上一层培养基是为了防止胶干燥,并给细胞补充营养,如果做药物处理,则在培养基中加入药物。
- 实验过程中琼脂温度控制在多少度?
琼脂放入水浴锅中维持在42℃左右。温度过低琼脂凝固,在做基底时琼脂凝固过快会导致不均一,温度过高则会将细胞烫死。此外,实验过程中速度要快,防止局部结块。
- 上层胶的细胞数目多少合适?
细胞数目根据不同的细胞类型而定。一般以5000个细胞/孔作为起始浓度,根据需要调整。
- 软琼脂克隆形成失败的原因有哪些?
细胞自身的因素,半固体环境要求细胞恶性程度高,容易生长,恶性程度低且依赖贴壁生长的细胞可能不适用于此法。
- 与平板克隆形成相比,各有什么特点?
平板克隆虽简单易行,但只适用于贴壁细胞,不能真实反应细胞在体内的三维生长状态。软琼脂克隆形成操作相对复杂,但更接近细胞在体内的三维生长状态,亦可用于肿瘤干细胞的培养分离,并且适用于悬浮细胞及不依赖于贴壁生长的肿瘤细胞[3]。
- 2种细胞克隆方式,如何选择?
根据实验对象和目的选择,平板克隆检测贴壁肿瘤细胞的增殖能力和致瘤性,软琼脂克隆形成实验除了检测贴壁细胞,还能检测悬浮肿瘤细胞和转化细胞系,具有平板克隆不可取代的优势。若只是简单评价贴壁细胞的增殖能力和群体依赖性,则选择平板克隆即可。
综上为本期为大家介绍的2种细胞克隆形成的实验方法,它们的操作过程很简单,但是我们会遇到很多小问题,导致最终结果不理想,切记,控制接种密度,铺板均匀是2大关键点,多多联系摸索,一定会有好数据和图片哦!
参考文献
1. Wang Z, et al. Tectonic 1 contributes to the growth and migration of prostate cancer cells in vitro. Int J Mol Med (2015).
2. ChiaoPei Cheng, et al. The mechanisms of malic enzyme 2 in the tumorigenesis of human gliomas. Oncotarget (2016).
3. 张迎,袁胜利,姜鹏飞,邢世超. 两种培养方法用于乳腺癌SK-BR-3 细胞克隆形成实验的对比研究. 山东医药2010 年第50卷第51期.


